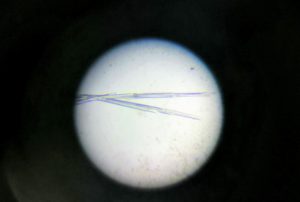
Krystaller av SMYD3
Forrige uke satt jeg opp krystalliseringsforsøk med den epigenetiske regulatoren SMYD3.
Gleden var stor da jeg så i mikroskopet i morrest og fant krystaller! Gruppen til Professor Helena Danielson har studert SMYD3 en stund,[1] og jeg reproduserte bare kjente betingelser, men det er fortsatt fint å se at man har det i fingrene. Jeg skal prøve å "soake", det vil si putte krystallene i en annen løsning, for å få inn allosteriske regulatorer av enzymet senere denne uken. Neste uke vil krystallene så bli testet på en av strålelinjene ved ESRF i Frankrike. Forhåpentligvis vil jeg da kunne se elektrontetthet for regulatorene og bygge inn de 3D koordinatene for molekylene.
SMYD3 er er implisert i noen kreftformer, og har som oppgave å sette metyl-grupper på spesifikke lysin-sidekjeder på spesifikke histoner. Histoner er med på å bygge opp strukturen til DNA slik det lagres i cellekjernene våre, og hvis du metylerer grupper på histonene så påvirker du hvor lett tilgjengelig enkelte segmenter av DNAet vårt er for å produsere proteiner. Epigenetikk kalles dette feltet, fordi den funksjonelle tolkningen av DNAet vårt kan endres av miljøet, selv om selve DNAet forblir uendret.
SMYD3 er av særlig interesse for prosjektet mitt siden det har et allosterisk sete, altså en plass på enzymet der molekyler kan binde som ikke er de katalytisk viktige. Danielson og hennes gruppe har vist at selv om du metter den allosteriske lommen med regulatorer, så går bare aktiviteten ned ~10 %, og det håper jeg at jeg kan bidra til å forstå med flere krystallstrukturer.
[1] Talibov VO, Fabini E, FitzGerald E, Tedesco D, Eriksson D, Talu MJ, Rachman MM, Mihalic F, Manoni E, Naldi M, Sanese P, Forte G, Signorile ML, Barril X, Simone C, Bartolini M, Dobritzsch D, Del Rio A, Danielson UH. Discovery of an allosteric ligand binding site in SMYD3 lysine methyltransferase. Chembiochem. 2021 Jan 5. doi: 10.1002/cbic.202000736