Nye protein kinase inhibitorer
Protein kinaser utgjør 2% av antall proteiner i kroppen vår. Protein kinaser overfører fosfat-grupper fra adenosin trifosfat (ATP) til andre proteiner, vanligvis på aminosyrene serin, treonin eller tyrosin som alle har en hydroksyl-gruppe.
Overføringen av fosfat-grupper er en av måten signaler formidles i kroppen vår.
I en stor organisme som et menneske er det utrolig viktig at cellene kan kommunisere med hverandre, og at de ulike komponentene i cellen er samkjørt. Da er det ikke rart at defekter i protein kinaser er koblet til en lang rekke sykdommer, når plutselig cellen oversvømmes av signaler eller ikke får noen tilbakemelding.
Protein kinaser er implisert i sykdommer fra kreft [1] til hårløshet[2], og er derfor et svært viktig mål for utvikling av nye legemidler.
Et stort problem er at de 500 protein kinasene vi har er svært like, spesielt der de binder ATP. Allikevel er det nettopp ATP-bindingssetet som har vist seg å være enklest å designe legemidler for[3].
I løpet av min mastergrad[4] var jeg så heldig at jeg fikk samarbeide med en sveitsisk gruppe fra ETH som hadde syntetisert en rekke nye forbindelser som de forventet at ville hindre en protein kinase som vi kaller PKA fra å overføre flere signaler.
PKA er en av de kinasene som påvirkes når du drikker kaffe[5], men den er også implisert i flere kreft-sykdommer. Vi kunne demonstrere at de nye inhibitorene den sveitsiske gruppen hadde syntetisert hadde aktivitet i mot blant annet PKA.
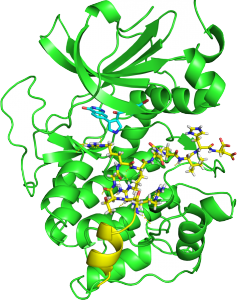
Mitt største bidrag til arbeidet var å vise hvordan to av inhibitorene interagerte med en mutert versjon av protein kinasen PKA. Det gjorde vi igjennom en prosess som heter krystallografi.
Krystaller som nesten ser ut som diamanter dyrkes frem av proteinet, men ingen dame blir imponert av en diamant på denne størrelsen, for de største krystallene blir sjeldent mer enn en millimeter lange.
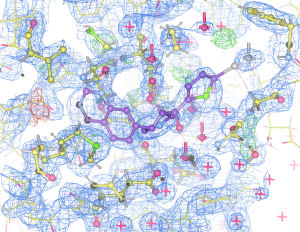
Hvis man klarer å få krystaller (og det er et stort hvis!) så kan man sende røngten-stråling igjennom et krystall, og atomene som står i et regelmessig gitter diffrakterer røngten-strålen slik at det dannes et diffraksjons-mønsteret. Igjennom en serie med fourier-transformasjoner og utregninger kan man fra diffraksjons-mønsteret få en modell over hvordan atomene er posisjonert i proteinet.
På denne måten kan man se nøyaktig hvilke interaksjoner en inhibitor har med et protein, og designe inhibitorene slik at de får mest mulig optimale interaksjoner.
[1] Lauber, B. S., Hardegger, L. A., Asraful, A. K., Lund, B. A., Dumele, O., Harder, M., Kuhn, B., Engh, R. A. and Diederich, F. (2015), Addressing the Glycine-Rich Loop of Protein Kinases by a Multi-Facetted Interaction Network: Inhibition of PKA and a PKB Mimic. Chem. Eur. J.. doi:10.1002/chem.201503552
[2] http://newsroom.cumc.columbia.edu/blog/2015/10/23/blocking-enzymes-in-hair-follicles-promotes-hair-growth/
[3] Åberg, E., Lund, B. A., Pflug, A., Gani, O. a. B. S. M., Rothweiler, U., de Oliveira, T. M., & Engh, R. a. (2012). Structural origins of AGC protein kinase inhibitor selectivities: PKA as a drug discovery tool. Biological Chemistry, 393(10), 1121–1129. doi:10.1515/hsz-2012-0248
[4] Biotech applications of protein kinase affinity interactions - Bjarte Aarmo Lund May 2013 http://hdl.handle.net/10037/8289